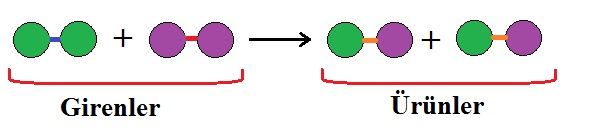
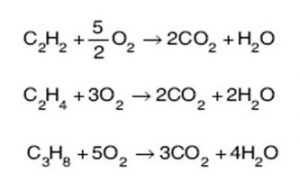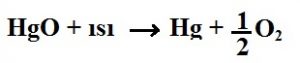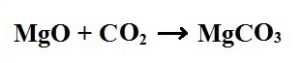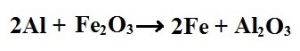Kimyasal tepkimelerde atomlar arası bağlar kopar ve farklı atomlar arasında yeni bağlar meydana gelir. Tepkime sırasında atomlar yeni bağlanma biçimleri ile farklı bileşiklerin oluşmasını sağlar.
 Kimyasal Tepkimelerin Özellikleri
Kimyasal Tepkimelerin Özellikleri
Kimyasal tepkimeler gerçekleşirken;
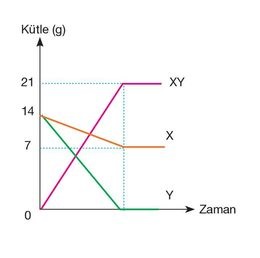
 * Atomların cinsi (çeşidi) değişmez (korunur).
* Atomların cinsi (çeşidi) değişmez (korunur).
* Atomların sayısı değişmez (korunur).
* Toplam kütle değişmez (korunur).
* Atomların çekirdek yükü değişmez (korunur).
– Molekül sayısı değişebilir (korunmaz).
– Elektron sayısı değişebilir (korunmaz).
– Fiziksel hal (katı,sıvı ve gaz olma durumu) değişebilir (korunmaz).
– Hacim değişebilir (korunmaz).
Not: Kimyasal tepkime sırasında maddelerde renk değişimi, katı madde (çökelek) oluşumu, gaz çıkışı ve ısı açığa çıkması gözlenebilir.
Kimyasal Tepkimelerin Denkleştirilmesi
Kimyasal tepkimeler denkleştirilirken şu işlemler sırayla yapılmalıdır:
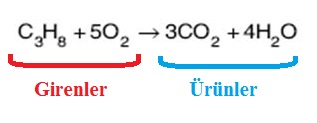
1. Tepkimeye girenlerin ve oluşan ürünlerin formülleri doğru yazılmalıdır.
2. Denklemin her iki yanındaki atom sayısı eşit olmalıdır.
3. Denklemde en çok atom içeren bileşiğe göre diğerlerine katsayı konulur.
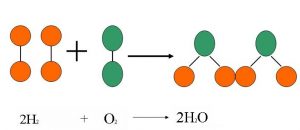
4. Denkleştirirken H2 ve O2 en son denkleştirilir.
5. Element moleküllerinin önüne rasyonel sayı gelebilir.
Kimyasal Tepkime Çeşitleri
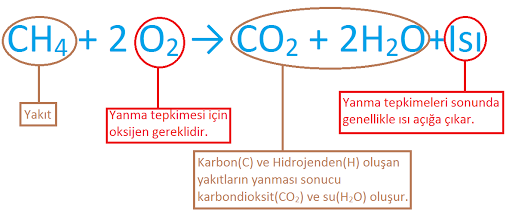
1. Yanma Tepkimeleri: Maddelerin O2 ile girdiği tepkimelerdir. Oksitlenme de denilen bu olayların tümü yanma tepkimesidir.
Hızlı Yanma: Kimyasal tepkime sırasında ısı ve ışık açığa çıkıyorsa bu tür yanma tepkimelerine hızlı yanma denir. Bu tip kimyasal tepkimelerde alev gözlenir.
Örnek: Odunun ve kömürün yanması
Yavaş Yanma: Kimyasal tepkime sırasında ısı ve ışık açığa çıkmıyorsa bu tür yanma tepkimelerine yavaş yanma denir.
Örnek: Demirin paslanması, gümüşün kararması NOT:
NOT:
![]() gibi O2’nin dışarıya çıktığı tepkimeler, yanma tepkimesi değildir. Yanma tepkimesi olması için O2, girenler tarafında olmalıdır.
gibi O2’nin dışarıya çıktığı tepkimeler, yanma tepkimesi değildir. Yanma tepkimesi olması için O2, girenler tarafında olmalıdır.
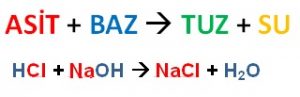
2. Nötralleşme (Nötrleşme) Tepkimeleri: Asit – baz tepkimelerine nötrleşme tepkimesi denir. Bu tepkime sonucunda su ve tuz oluşur.
3. Analiz (Ayrıştırma) Tepkimeleri: Bir bileşik kendinden daha basit maddelere ayrışıyorsa bu tepkimelere denir.
4. Sentez (Birleştirme) Tepkimeleri: İki ya da daha çok maddenin birleşerek tek tür madde oluşlturmasıyla gerçekleşen tepkimeye denir.
5. Yer değiştirme Tepkimeleri: Maddeler arasında atomların yer değiştirdiği tepkimelerdir.
Isı Alışverişine Göre Tepkimeler
Isı alışverişine göre tepkimeler ikiye ayrılır: Endotermik ve egzotermik tepkimeler.
Endotermik Tepkimeler: Tepkimenin gerçekleşebilmesi için ısı alan tepkimelerdir.
Örnek: Ayrıştırma tepkimeleri
Egzotermik tepkimeler: Tepkime sonucunda ısı açığa çıkaran tepkimelerdir.
Örnek: Yanma tepkimeleri