Isı alış-verişi sorularını çözebilmek için öncelikle formüldeki değişkenlerin ne anlama geldiğini ve aralarındaki ilişkiyi çok iyi bilmemiz gerekir. Bu nedenle öncelikle bu kavramların birbirini nasıl etkilediğini inceleyelim.
Kütle ve Sıcaklık Arasındaki İlişki (m ve Δt)
Aynı cins iki maddeye eşit ısı verildiğinde (yani c-öz ısı Q aynı olmak koşuluyla) kütlesi az olanın sıcaklığı fazla artacaktır. Başka bir deyişle c (öz ısı) ve Q(ısı) aynı ise kütle (m) ve sıcaklık değişimi (Δt) ters orantılıdır.
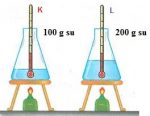 Örnek: Özdeş ısıtıcılara beher içerisinde 200 g ve 100 g miktarında su koyularak eşit süre ısıtılırsa kütlesi 100 g olan suyun sıcaklığı daha fazla artacaktır.
Örnek: Özdeş ısıtıcılara beher içerisinde 200 g ve 100 g miktarında su koyularak eşit süre ısıtılırsa kütlesi 100 g olan suyun sıcaklığı daha fazla artacaktır.
Kütle ve Isı Arasındaki İlişki (m ve Q)
Aynı sıcaklıkta, aynı türden yapılmış maddelerden kütlesi büyük olanın ısısı fazladır. Başka bir deyişle aynı sıcaklıkta bir bardak su ile bir sürahi suyu aynı sıcaklığa çıkarabilmek için, bir sürahi suya daha fazla ısı vermek gerekir. Yani bu durumda kütle (m) ile ısı (Q) doğru orantılıdır.
Örnek: Küçük su şişesine doldurulmuş ve büyük su şişesine doldurulmuş aynı sıcaklıkta suların bize verebileceği ısı miktarını karşılaştırınız?
Aynı sıcaklıkta olmalarına rağmen, kütlesi fazla olan suyun içerisindeki ısı daha fazladır. Bu nedenle büyük şişe içerisindeki su bize daha fazla ısı verir.
Örnek:  Sıcaklıkları 90 °C olan, 200 g ve 100 g suya 0 santigrat derecede aynı büyüklükte birer buz parçası atılıyor olsun. Hangi kapta daha fazla miktarda buz erir?
Sıcaklıkları 90 °C olan, 200 g ve 100 g suya 0 santigrat derecede aynı büyüklükte birer buz parçası atılıyor olsun. Hangi kapta daha fazla miktarda buz erir?
Madde miktarı (kütlesi) fazla olan suyun içerisinde bulunan ısı miktarı da fazla olacaktır. Bu nedenle 100 g su daha fazla buz eritir.
Isı ve Özısı Arasındaki İlişki (Q ve c)
Kütleleri aynı, özısıları farklı maddeleri aynı sıcaklığa getirebilmek için verilmesi geren ısılar da farklı olacaktır. Şöyle ki özısısı fazla olan maddeye daha fazla ısı verilmesi gerekir. Ayrıca özısısı yüksek olan maddelerin çevreye verebildikleri ısı miktarı da fazladır. O halde ısı (Q) ve özısı (c) doğru orantılıdır.
Bu konuyu bir önceki yazımızda detaylı olarak anlatmıştık. Detaylı bilgi için Isı Enerjisi ve Öz ısı İlişkisi adlı yazımıza tıklayabilirsiniz.
Örnek: 50 g su ve alkole, aynı derecede sıcaklık artışı meydana getirebilmek için suya alkolden daha fazla ısı verilmesi gerekir. Çünkü csu:4,18 ve calkol:2,54’tür. Yani suyun özısısı alkolün özısısından fazladır. O halde her iki sıvıda da aynı sıcaklık değişimini yapabilmek için su daha fazla ısıtılmalı başka bir deyişle su, alkolden daha fazla ısı almalıdır.
Isı ve Sıcaklık Arasındaki İlişki (Q ve Δt)
Bir maddeye ne kadar fazla ısı verilirse sıcaklığı da o kadar artar. Bununla birlikte madde ne kadar ısı verirse sıcaklığı da o kadar azalır. Bu durumda ısı ve sıcaklık doğru orantılıdır.
Şimdi yukarıda öğrendiğimiz kavramların ilişkilerini özetleyecek olursak;
m ve Q doğru orantılıdır.
m ve Δt ters orantılıdır.
Q ve c doğru orantılıdır.
c ve Δt ters orantılıdır.
Q ve Δt doğru orantılıdır.
Bu ilişkileri de bir formül altında birleştirelim. Birbiriyle doğru orantılı olanları eşittirin karşılıklı taraflarına yazmalıyız. Birbiriyle ters orantılı olanları ise eşittirin aynı taraflarına yazmalıyız.
Q: Isı
m: Kütle
c: Özısı
Δt (t2-t1): Sıcaklık farkı
Isı hepsi ile doğru orantılı, eşittirin aynı tarafında olanlar yani çarpım durumunda olanlar ise ters orantılıdır. Buradan formülümüz;
Isı = Kütle x Özısı x Sıcaklık farkı
Q=m.c.Δt
formülümüz ortaya çıkar. Hatırda kalması için Q=m.c.Δt formülünü “KÖR MACİT ya da KEL MACİT” şeklinde kodlayabiliriz.
Isı Alış-verişi Nedir?
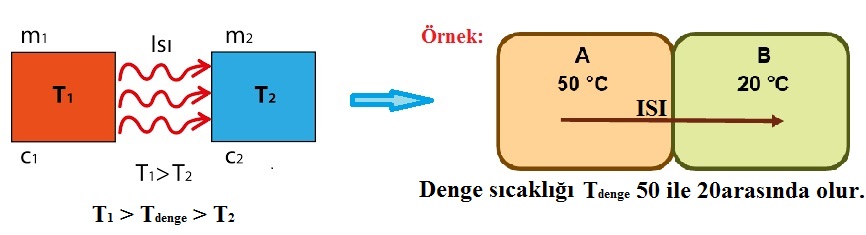 * Sıcaklıkları farklı iki madde arasında ısı alış-verişi gerçekleşir.
* Sıcaklıkları farklı iki madde arasında ısı alış-verişi gerçekleşir.
* Sıcaklığı fazla olan madde ısı verirken, sıcaklığı az olan madde ısı alır.
* Isı alış-verişi son sıcaklıkların eşitleninceye kadar devam eder.
NOT: Sıcaklıkları aynı olan iki madde arasında ısı alış-verişi gerçekleşmez.
NOT: Bu konuyla ilgili sorular ve çözümler için Isı Alış-verişi ile İlgili Sorular ve Çözümleri linkimizi inceleyebilirsiniz.