Bileşikler, farklı cins maddelerin kimyasal yollarla biraraya gelerek ve kendi özelliklerini kaybederek oluşturduğu yeni özelliklere sahip saf maddelerdir. Bileşikler, kendilerini oluşturan iyonların (anyon ve katyonların) yük dengesini sağlamak için oluşurlar. Formüllerle gösterilirler.
Bileşiklerin Formüllerle Gösterilişi ve Yazılışı
Bileşiklerin formülü, bileşik molekülünü oluşturan atomların türünü ve atomların moleküldeki sayılarını gösteren yapıdır.
Örnek: H2O, CO2, HCl, H2SO4, NaOH
Bileşiklerin formüllerini yazabilmemiz için öncelikle bileşiği oluşturan elementlerin iyon yükünü bilmemiz gerekir. Elementin iyon yükünü bulmak için de elektron dağılımı yapmamız gerekir. Daha önce elementlerde elektron dağılımının nasıl yapılacağını öğrenmiştik.
(Elementlerin iyon yükünü nasıl bulacağımızı öğrenmek için Elementlerin İyon Yükü adlı yazımızı inceleyebilirsiniz.)
(Elementlerin elektron dağılımının nasıl yapılacağı ile ilgili detaylı bilgi edinmek için Elementlerin Periyodik Tablodaki Yerinin Bulunması adlı yazımızı inceleyebilirsiniz.)
(Bileşiklerin iyonik yapılı mı kovalent yapılı mı olduğunu nasıl ayırt edeceğinizi öğrenmek için Kimyasal Bağ Nedir? Çeşitleri Nelerdir? adlı yazımızı inceleyebilirsiniz.)
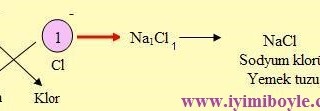
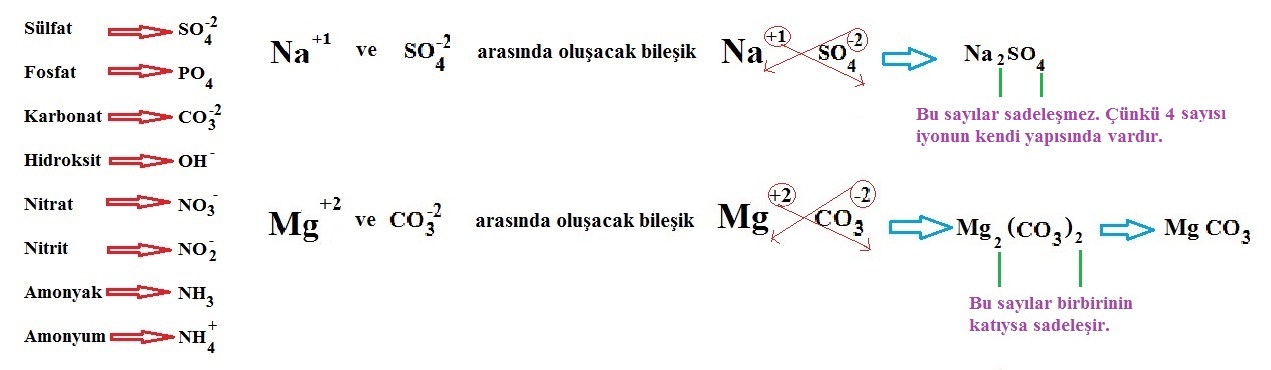
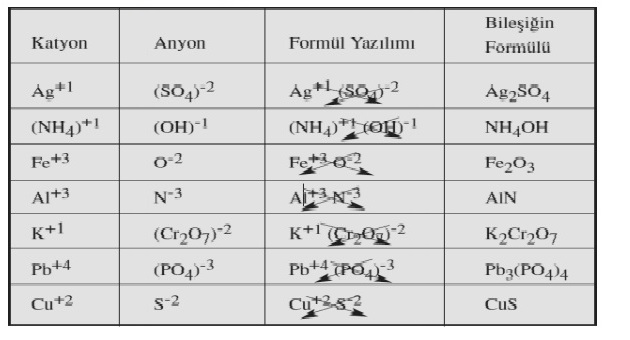
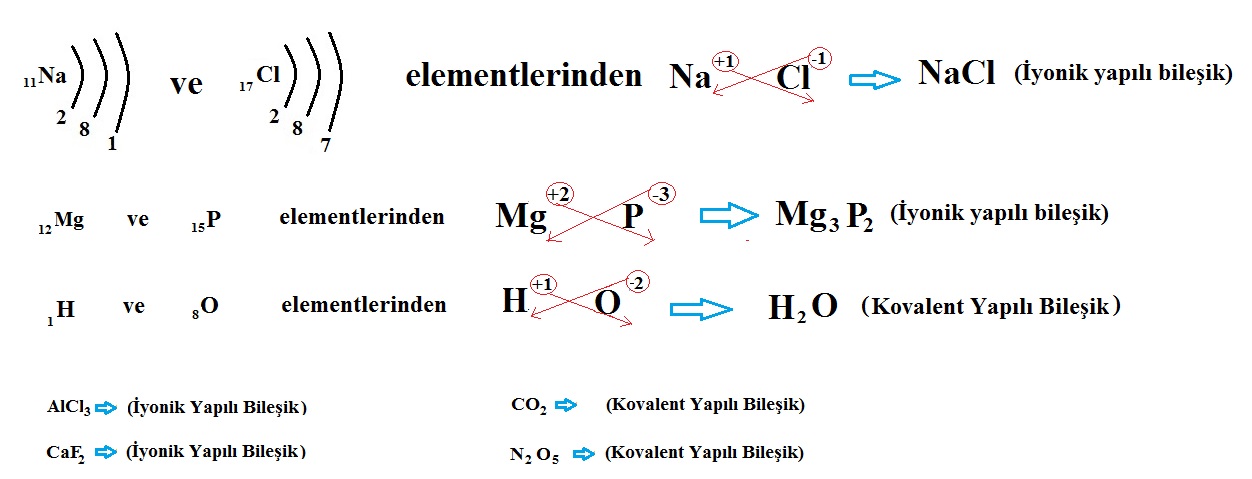
Elementlerin iyon yükleri tespit edildikten sonra çaprazlanır. Şöyle ki katyonun (+ yüklü iyon) yük miktarı anyonun, anyonun (- yüklü iyon) yük miktarı katyonun sağ alt köşesine yazılır. Bileşiğin formülü yazılırken önce katyon, sonra anyon yazılır. Anyon ve katyondaki 1 (Bir) rakamı yazılmaz.
Bileşiğin tek atomlu iyonlardan veya çok atomlu iyonlardan oluşmasına göre formüllerinin nasıl yazıldığını inceleyelim.
a) Tek Atomlu İyonların Oluşturduğu Bileşiklerin Formüllerinin Yazılması
 b) Çok Atomlu İyonların Oluşturduğu Bileşiklerin Formüllerinin Yazılması
b) Çok Atomlu İyonların Oluşturduğu Bileşiklerin Formüllerinin Yazılması
Çok atomlu iyonlar da tek atomlu iyonlar gibi çaprazlanır. Ancak çok atomlu iyonlar atom grubu olduğu için içindeki atom sayısı fazladır. Bu nedenle çaprazlandıktan sonra çok atomlu iyonun sayısı 1 ise zaten yazılmaz ama 1’den farklı bir rakamsa karışıklık olmaması için çok atomlu iyonun sayısı parantez içinde belirtilir.
Konu hakkında detaylı bilgi edinmek için aşağıdaki yazılarımızı inceleyebilirsiniz.
Maddenin Yapısı ve Özellikleri
Elementler ve Kullanım Alanları
Elementlerin Sınıflandırılması-Metaller, Ametaller, Yarı Metaller ve Soygazlar
Elementlerin Periyodik Tablodaki Yerinin Bulunması
Periyodik Tablo ve Özellikleri
Periyodik Cetvelin Özelliklerinin Değişimi
Kimyasal Bağ Nedir? Çeşitleri Nelerdir?
Bileşiklerin Adlandırılması ve Bileşiklerin Yapısındaki Atom Sayısının Bulunması
Asitler, Bazlar ve Tuzların Özellikleri
Asitler ve Bazların Kullanım Alanları
Asit Yağmurları ve Çevreye Etkileri